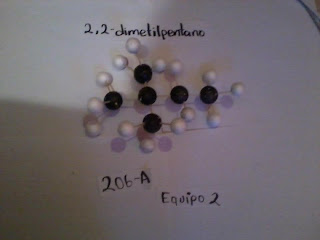* Nomenclaturas
> Alcanos Simples
La regla consiste en utilizar una raíz y un sufijo para dar nombre al compuesto.La raíz del nombre nos indica el número de átomos de la cadena principal. El sufijo representa el tipo de compuesto o función química.
No. Carbonos
|
Nombre
|
1
|
Metano
|
2
|
Etano
|
3
|
Propano
|
4
|
Butano
|
5
|
Pentano
|
6
|
Hexano
|
7
|
Heptano
|
8
|
Octano
|
9
|
Nonano
|
10
|
Decano
|
11
|
Undecano
|
12
|
Dodecano
|
13
|
Tridecano
|
14
|
Tetradecano
|
15
|
Pentadecano
|
16
|
Hexadecano
|
17
|
Hepta-decano
|
18
|
Octadecano
|
19
|
Nonadecano
|
20
|
Eicosano
|
>Cicloalcanos
Los HC cíclicos alifáticos se nombran de manera semejante a los Alcanos simples solo que ahora se antepones el prefijo ciclo seguido del nombre del hidrocarburo.
Ejemplo : Ciclopentano
GRUPO ALQUÍLICO
Se forma al eliminarse un hidrogeno de un alcano y su nombre resulta de sustituir la terminación ano, del alcano correspondiente, por el sufijo o terminación il o ilo
REGLAS DE NOMENCLATURA DE LOS ALCANOS
- Se selecciona la cadena continua de carbonos más larga
- Se enumera la cadena por el extremo donde se encuentra mas próxima una ramificación
- Se nombran los grupos alquílicos unidos a la cadena principal. Existen dos formas váli-das para ordenar los sustituyentes:
en orden alfabético y por orden de complejidad.En la actualidad, el orden
alfabético tiende a ser el más utilizado en la mayoría de los casos. En este
libro utilizaremos el orden alfabético para lo cual es necesario establecerlas
siguientes normas:
a) Cuando existan dos o más
sustituyentes iguales, se emplearán los prefijosdi, tri, tetra, penta, etc., según corresponda. Al
establecer el orden alfabético, la primera letra deestos prefijos, no se
utilizará para ordenar, sólo se considerará la primera
letra delnombre del grupo alquílico.
b) De la misma manera, los
prefijos ter-y sec-,no se utilizarán para ordenar.
c)En cambio, la primera letra
de los prefijos iso, neo y ciclo, sí se
utilizarán para ordenar alfabéticamente, pues se consideran parte del nombre.
d) Cuando se desea indicar
la posición de los grupos alquílicos
en la cadena, es preciso
tener en cuenta que los números se separan con comas
entre sí, y con
un guion para separarlos del nombre.
e) En sustituyentes complejos (ramificados), la IUPAC acepta la
utilización de nombres comunes donde sea posible, por ejemplo:
sec− butil, ter− butil, neopentil. Pero
en aquellos grupos más
ramificados, se elige la cadena
carbonada mas larga, ésta se numeradando el localizador 1 al carbono unido
directamente a la cadena principal.
-Finalmente se da nombre a la cadena carbonada más larga, como
si fuera un alcano de cadena normal, de acuerdo con el número de átomos de
carbono que posea colocándolo enseguida del nombre del último sustituyente sin separarlo.
> Nomenclatura de los Alquenos
Para los alquenos al igual que con los Alcanos se usa una raíz del nombre que indica el número de carbonos que hay en la cadena solo que ahora la terminación ano se sustituye por la terminación ileno.
Según la UIPAC, los alquenos se nombran como derivados de un alcano matriz. La raíz alquílica indica el número de carbonos en la cadena y el sufijo eno la presencia del doble enlace.
REGLAS:
- Se selecciona la cadena mas larga de átomos de carbono que contenga el doble enlace
- Se enumeran los carbonos donde el doble enlace que de mas cercano, es decir, que tenga el número mas pequeño.
- Se nombran los grupos alquílicos unidos a la cadena principal y se colocan en orden alfabético indicando por medio de un número su posición en la cadena y finalmente se da nombre a la cadena principal indicando la posición del doble enlace.
>Nomenclatura de los Alquinos
En el sistema IUPAC
estos compuestos se nombran como derivados de un alcano
matriz. La raíz indica el número de carbonos en la cadena y el sufijo –ino, la presencia del triple enlace
en la cadena. Las reglas son las mismas que
se utilizaron en la nomenclatura de alquenos, con la diferencia que
éstos llevan la terminación –ino.
REGLAS:
- Se busca la cadena mas larga.
- Se enumera la cadena por el extremo mas cercano al triple enlace.
- Se nombran los grupos alquílicos unidos a la cadena ordenándolos alfabéticamente.
- Se nombra la cadena principal, indicando la posición del triple enlace.
*Propiedades de los Alcanos
> Porpiedades Químicas
Los alcanos o prafinas son bastantes inerte, como su nombre lo dice; sin embargo los que tienen de 1 a 10 carbonos son mas activos que el resto.
Estos compuestos son combustibles, Producen dioxido de carbono y agua y liberan gran cantidad de enrgía térmica y luminosa.
Los Alcanos reaccionan con los halógenos en presencia de luz, formando acído clorhídrico y derivado halógenos.
>Propiedades Físicas
A temperatura ambiente, los primeros 4 términos de esta serie con gaseosos; los que tiene de 5 a 16 átomos de carbono líquidos; y salidos de los que tiene 17 o más átomos de carbono en su molécula. Por ejemplo el hexadecano se funde a 18°C.
Los Alcanos son incoloros y tienen color característico Su densidad conforme aumenta su número de átomos de carbono.
*Propiedades de los Alquinos.
>Propiedades físicas.
Son compuestos de baja polaridad, por lo que sus propiedades físicas son muy semejantes a la de los alquenos. Son insolubles en agua, solubles en disolventes no polares, son menos densos que el agua. Sus puntos de ebullición aumentan al aumentar el número de carbonos. A temperatura ambiente, los tres primeros términos son gases, los términos intermedios son líquidos y los superiores son sólidos
>Propiedades químicas.
Los alquinos dan reacción de adición a los carbonos de la triple ligadura, al igual que los alquenos.
*Propiedades de los Alquenos
>Propiedades físicas
A la temperatura y presión ordinarias los tres primeros alquenos normales son gases (C2H4 al C4H8); los once siguientes son líquidos (C5H10 al C15H30); y los términos superiores son sólidos, fusibles y volátiles sin descomposición, a partir del C16H32.
Por lo general, el punto de ebullición, el de fusilón, la viscosidad y la densidad aumentan conforme el peso molecular.
>Propiedades químicas
Contra lo que podría suponerse, la doble ligadura constituye la región más débil de la molécula, y por tanto, es fácil romperse en presencia de los agentes químicos dando productos de adición.
El enlace que se produce por dos electrones, y que garantiza la firme unión de los átomo de carbono, es un enlace sigma(o-); el enlace adicional formado entre los dos átomos de carbono por el otro par de electrones, y que es el responsable de la copocidad para entrar en reacción que exhiben las moléculas que tienen es un enlace (pi). Los enlaces de este último tipo se encuentran en orbitales de forma muy parecida a palanquetas (forma de lazo), cuyo plano de vibración es perpendicula al del enlace sigma (o-) y, por tanto, sobresalen en cierto modo de la molécula; por esto, están capacitados para formar, con otros átomos, enlaces sigma más estables.
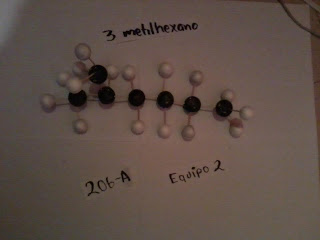
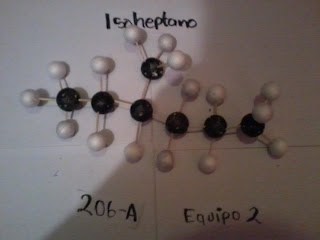
¿Qué es un Isómero ?
Que tiene la misma composición química y la misma masa molecular, pero con diferentes propiedades y estructura atómica.
El Hexano tiene 4 Isómeros y el heptano 8
>>Referencias